Suun karsinooma
Koska suullisen karsinooman diagnoosin, hoidon ja seurannan tyypistä ja laajuudesta on toistaiseksi ollut erilaisia näkemyksiä, oli välttämätöntä laatia S3-ohje (LL). Siihen osallistui useita ammattiyhdistyksiä ja -järjestöjä. Tässä on yhteenveto yli 100 sivusta paperia.
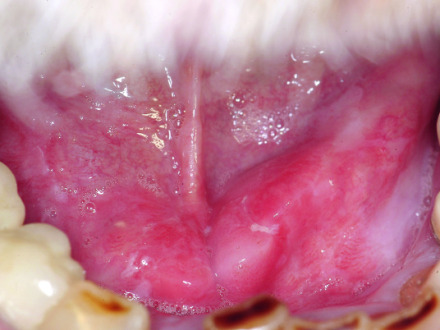
Alkuperäiset havainnot: Suun karsinooma Kuva: K.-D. Wolff-TU München
Klaus-Dietrich Wolff et ai.
Suuontelossa kehittyy noin 10 000 uutta tapausta vuodessa, mikä on viisi prosenttia kaikista pahanlaatuisista kasvaimista. Nämä ovat 95 prosentin osuudella pääosin okasolusyöpäjä, joihin liittyy usein kroonisen alkoholin väärinkäytön ja tupakan kulutuksen riskitekijöitä [Talamini et al., 2003]. Ihmisen papilloomaviruksen (HPV 16) havaitseminen seerumissa voi myös olla riskitekijä suun ja nielun karsinoomassa [Herrero et ai., 2003]. Varsinkin miehet (noin 7500 vuodessa), mutta yhä enemmän myös naiset; Miehillä tämä tauti on kaikkien pahanlaatuisten kasvainten seitsemännessä paikassa. Vaikka esiintyvyyden kasvu on todettu maailmanlaajuisesti, yleinen käsitys tästä ongelmasta on heikko [Cruz et al., 2002]. Lisäksi diagnoosin, hoidon ja seurannan tyypistä ja laajuudesta on usein erilaisia näkemyksiä. Tämä johti selvästi S3-suuntaviivojen tarpeeseen, jossa tieteelliset todisteet ja Saksassa suun syöpäpotilaiden käytännön hoito analysoitiin, punnittiin, arvioitiin ja annettiin selkeät suositukset.
metodologia
Ohje on laadittu DKG: n Onkologian ohjeohjelman metodologisella tuella. Käynnistyskokouksessa ohjeistusryhmä määritteli ensin 37 diagnoosiin, hoitoon ja jälkihoitoon liittyvää asiaa, joita sitten analysoitiin systemaattisesti viidessä työryhmässä ja Charité Berliinin "todisteisiin perustuvan lääketieteen osaston" ammattimaisella tuella Kirjallisuustutkimukseen ja todisteiden käsittelyyn vastattiin. Lisäksi tutkimuksia tehtiin jo julkaistuista ohjeista; Niiden ajantasaisuuden ja metodologisen rakenteen vuoksi SIGN (Scottish Intercollegiate Giudelines Network) 90 -ohje valittiin lähdeohjeeksi. Noin 3 000 asiaa koskevasta tiivistelmästä yksilöitiin noin 250 artikkelia, joista 117 oli merkityksellisiä jatkoanalyysille. Kirjallisuutta, johon mukautettu SIGN-90 -ohje perustui, verrattiin riippumattoman de novo -tutkimuksen tuloksiin ja arvioitiin sen todisteiden perusteella uudelleen. Jokaista tutkimusta arvioitiin todistustasolla 1 ++ (korkealaatuiset metaanalyysit) 4: een (asiantuntijalausunto). Päättävässä konsensuskonferenssissa kaikkiin alun perin määriteltyihin avainkysymyksiin vastattiin tehdyn tutkimuksen perusteella ja sovittiin nimellisryhmäprosessin muodossa..
tulokset
Seuraavat lausumat on muotoiltu kolmella suositusasteella, joissa "pitäisi" on vahva suositus, "pitäisi" olla suositus ja "voi" olla avoin suositus. He tekevät yhteenvedon LL: n suosituksista toistamatta niitä sanatarkasti.
Kaikki potilaat, joilla on enemmän kuin kaksi viikkoa epäselviä limakalvovaurioita, on ohjattava heti lääkäriin selvitystä varten. Epäillään olevan minkä tahansa suun limakalvon muutosta kudosylijäämän ja / tai kudosvaurion kanssa, samoin kuin värin muutosta tai limakalvon kovettumista. Tyypillinen on keskushaava, jolla on reunakehä ja valkeahko (leukoplakic) kerrostuminen johtuen maissiutumisesta (keratinisaatiosta), joka voi puuttua kokonaan. Varhaiset löydökset esitetään esimerkiksi nodulaarisena epiteelin paksuuntumisena tai litteän pinnan vauriona. Jo alun perin voi olla hampaiden löystymistä tai imusolmukkeiden turpoamista kaulassa, jotka voidaan sekoittaa tulehduksellisiin sairauksiin, kuten periodontaaliseen tautiin tai lymfadeniittiin. Perushammasdiagnoosina panoraamakomitean tomogrammin tulisi olla saatavilla myös hammastilan arvioimiseksi, myös mahdollisen sädehoidon kannalta. Cone Beam CT: n (DVT) lisäedusta panoraamattomografialla ei ole varmaa näyttöä mandibulaarisen luun hyökkäyksen arvioimiseksi [Hendrikx et al., 2010]..
Tuumorispesifisen hoidon aloittamiseksi kasvaimen havaitseminen histologian avulla on edellytys. Koska biopsia johtaa paikallisiin kudosreaktioihin, jotka saattavat vääristää varjoaineen kuvantamista (CT, MRI), näytteenotto kliinisesti ilmeisistä kasvainhavainnoista suositellaan vasta kontrastin parannetun kuvantamisen jälkeen. Kudosnäytteen on poistettava erikoislääkäri kasvaimen etenemisvyöhykkeeltä, ts. Sen reuna-alueelta, ei nekroottisesta keskustasta. Biopsian uuton tavanomainen muoto on leikkausbiopsia skalpelin avulla. Harjabiopsian tapauksessa on huolehdittava siitä, että se on riittävän syvä poistamalla koherentit kudoshiukkaset ja provosoimalla verenvuoto väärien negatiivien välttämiseksi.
Suussyövän hoito on suoritettava monitieteellisesti kunkin yksittäistapauksen koordinoinnin jälkeen kasvainlautakunnissa, joihin kuuluvat suun ja leukakirurgian, otorinolaringologian, sädehoidon, onkologian, patologian ja radiologian osa-alueet. Hammaslääkärin tilan määrittämiseksi kokeneen hammaslääkärin tulee suorittaa tutkimus ennen hoidon aloittamista. Hoidossa tulee ottaa huomioon potilaan yksilöllinen tilanne. Jos potilaan yleinen tila sen sallii, leikkaus tulisi suorittaa parantavasti resetoitavalle suun karsinoomalle. Tässä yhteydessä korjaavien toimenpiteiden tulisi periaatteessa olla osa kirurgista konseptia. Jälleenrakentaminen tulisi suunnitella ottaen huomioon yleinen onkologinen tilanne. Jälleenrakennuksen kustannukset olisi perusteltava odotetulla toiminnallisella tai esteettisellä parannuksella. Kirurgisesta hoidosta on tehtävä päätös ottaen huomioon kasvaimettomien resektiomarginaalien saatavuus ja leikkauksen jälkeinen elämänlaatu. On huomattava, että alle millimetrin etäisyyttä histologisesti havaittavissa olevan kasvaimen rajan ja resektiomarginaalin välillä pidetään positiivisena leikkausmarginaalina [McMahon et ai., 2003]. Resektiota, jonka histologisesti vahvistettu turvallisuusmarginaali on yksi – kolme millimetriä, kutsutaan vähäiseksi resektiomarginaaliksi, vähintään 500 mm: n resektiota turvallisena resektiomarginaalina. Kasvaimeen liittyvät tai niukot resektiojärjestelmät huonontavat merkittävästi ennustetta [Loree ym., 1990] Vaikka ennusteen paranemista ei ole ollut mahdollista osoittaa käyttämällä nopean leikkauksen histologiaa kasvaimen rajojen intraoperatiiviseen arviointiin, tämä menetelmä on hallitsematon tai väistämättä radikaalimpi sen välttämiseksi. Resektioista on hyötyä [Ribeiro et al., 2003]. Siksi voidaan olettaa, että intraoperatiivisen pakastetun osan histologia edistää merkittävästi R0-resektion suojaamista ja rakenteen ja toiminnan säilyttämistä. Alaleuan jatkuvuus tulisi säilyttää kasvaimen resektion aikana, kunhan kuvantamista tai intraoperatiivista näyttöä kasvaimen tunkeutumisesta luuhun ei voitu antaa.
Erottamaton osa suun karsinooman hoitoa on kohdunkaulan imusolmukkeiden hoito, joka voidaan preoperatiivisesta diagnostiikasta (ultraääni, CT, MRI) riippuen luokitella kliinisesti huomaamattomaksi, epäilyttäväksi tai erittäin epäilyttäväksi kasvaimen hyökkäyksen suhteen. Hoitopäätöksessä on kuitenkin otettava huomioon, että histologisesti 20 – 40 prosenttia okkulttisista metastaaseista löytyy myös kliinisesti ja havaittavien havaintojen kuvantamisessa [Coatesworth et al., 2003; Byers et ai., 1988]. Siksi jopa potilailla, joilla on kliinisesti merkitsemätön imusolmukkeiden tila, selektiivinen niskaleikkaus tulisi suorittaa T-luokasta riippumatta.
Vaikka kemoradioterapialle ei ole viitteitä alkuvaiheissa tai pienissä suun karsinoomissa, suuontelon edenneet toimivat karsinoomat (T3 / T4) tulisi hoitaa yhdistelmällä leikkausta ja kemoterapiaa. Postoperatiivista radio- tai kemoradiohoitoa tulisi jatkaa, jos niukkalla tai positiivisella resektiomarginaalilla, perineuraalisella hyökkäyksellä, verisuonten tunkeutumalla ja / tai imusolmukkeilla. Postoperatiivinen sädehoito tulisi aloittaa mahdollisimman varhaisessa vaiheessa ja lopettaa korkeintaan 11 viikon kuluessa leikkauksesta [Ang et al., 2001]. Primaarisen sädehoidon indikaatio annetaan, kun täydellistä kasvaimen resektiota ei voida saavuttaa tai kun leikkaus johtaisi elämänlaadun huomattavaan heikkenemiseen. Potilailla, joilla on pitkälle edennyt, leikkaamaton ja ei-metastaattinen oraalinen karsinooma, ensisijaista radiokemiahoitoa tulisi suosia pelkästään sädehoitoon, etenkin alle 70-vuotiailla [Pignon et al., 2009] sädehoidon toksisuuden vähentämiseksi, mutta ei samanaikaisesti Paikallisen tuumorikontrollin tai yleisen eloonjäämisen heikentymisen alkaessa intensiteettisäädetty säteilytyshoito (IMRT) on otettu käyttöön potilaille, joilla on pään ja kaulan syöpä. Tavoite välttää säteilyn aiheuttamaa kserostomiaa vähentämällä annosta sylkirauhasille saavutettiin ensimmäisissä tapaussarjoissa [Chao et ai., 2001]. Jos sylkirauhaset jäävät, pilokarpiinin oraalinen antaminen (5-10 mg kolme kertaa päivässä) parantaa suun kuivumista ja vähentää keinotekoisten syljen tarvetta [Fisher et ai., 2003]..
Suussyövän hoidossa varhainen hammashoito on välttämätöntä muuten yleisesti esiintyvän hampaiden menetyksen tai säteilykarieksen torjumiseksi suunnitellun tai aiemman sädehoidon tapauksessa; Tähän sisältyy myös fluorauksen ja tarvittaessa välikappaleen valmistaminen ennen sädehoidon alkua. Koska hampaan uuton jälkeiset komplikaatiot voivat olla merkittävä ongelma, on ehdottoman välttämätöntä, että kaikki säteilytettyyn leuaseen kohdistuvat interventiot suoritetaan yksinomaan asianmukaisesti koulutettujen vertaisten kanssa, joilla on kirurginen asiantuntemus [Epstein et al., 1998]. Vakavin komplikaatio on tartunnan saanut osteoradioninekroosi, jonka keskimääräinen esiintyvyys ilmoitetaan viideksi prosentiksi [Tong et ai., 1999]. Osteoradionekroosin riski kasvaa entisestään, kun kasvaimen tunkeutumista leualuun on säteilytetty. Yleisimmin vaikuttaa alakalvon molaarinen alue, ja usein tartunnan saaneen osteoradionekroosin on edeltänyt hampaan uutto. Tuumorin uusiutumisen säteilyhoito yli 60 Gy: n kokonaisannoksilla aiheuttaa usein tartunnan saaneen osteoradiaalinekroosin 20%: lla tapauksista, usein kemoterapian yhteydessä [Pasquier et al., 2004]. Tämän komplikaation hoito vaihtelee systeemisestä antibioottihoidosta tartunnan saaneen luun poistamiseen ja sekventrotomiaan vaikutuksen saaneen leukaosan jatkuvuuden resektioon, jolloin myöhempi aiempien leikkausten ja säteilyn aiheuttama rekonstruktio on teknisesti vaativa. Hyperbaarisen happiterapian hyödystä osteoradioninekroosin estämiseksi tai hoitamiseksi ei ole riittävästi näyttöä. Monikeskinen tapauskontrollitutkimus ei osoittanut mitään hyötyä hyperbaarisesta happiterapiasta potilaille, joilla on osteoradioninen nekroosi, kun niitä suoritetaan ilman lisäkirurgisia toimenpiteitä [Annane et al., 2004].
Tuumorin uusiutumisen hoito:
Yleisin syy epäonnistuneeseen primaarikasvaimen hoitoon ja myöhemmin tuumoriin liittyvään kuolemaan on paikallisen kasvaimen toistuminen; Sitä esiintyy suun kautta tapahtuvassa karsinoomassa noin viidenneksellä potilaista. Parantavia terapeuttisia vaihtoehtoja näissä tapauksissa ovat uudelleenoperaatio (pelastusleikkaus) [Goodwin, 2000] tai / ja radio- tai kemoterapiahoito [Haraf et ai., 1996]. Soveltuvaa toimintatapaa koskevan päätöksen tulee perustua potilaan yksilölliseen tilanteeseen, kasvaimen uusiutumisen vaiheeseen ja sen mahdolliseen resektoitavuuteen, aikaisempaan hoitoon, hoidon todennäköiseen tehokkuuteen ottaen huomioon sen riskit ja elämänlaatu, yleinen fyysinen kunto ja etenkin potilaan halu on otettava huomioon. Hoitopäätöksen tekee kasvainlautakunnan monitieteinen ryhmä sen jälkeen, kun uusiutumisen histologinen vahvistus ja uudelleenvaihe on vahvistettu. Potilaille ja heidän sukulaisilleen on tiedotettava yksityiskohtaisesti hoidon riskeistä ja uuden kirurgisen tai konservatiivisen hoidon onnistumismahdollisuuksista, myös pysyvän parannuksen suhteen, etenkin odotettavissa olevan elämänlaadun suhteen. Toimenpiteen saa suorittaa vain kokenut kirurginen ryhmä, jolla on laajat rekonstruointimahdollisuudet, ja laitoksessa, jossa on sopiva tehohoitolaitos. Toissijainen säteilytys olisi mieluiten suoritettava kliinisessä tutkimuksessa.
Potilailla, joilla on edennyt, uusiutunut tai metastasoitunut pään ja kaulan syöpä ilman parantavaa hoitoa, 10 – 35 prosentin vasteaste voidaan saavuttaa palliatiivisella kemoterapialla [Schornagel et ai., 1995]. Vaikka palliatiivisen kemoterapian vasteprosenttia voidaan parantaa yhdistelmällä erilaisia sytotoksisia aineita, pidentyneestä eloonjäämisestä ei ole näyttöä [Gibson et al., 2005]. Reaktioasteen paranemiseen yhdistelmäkemoterapialla liittyy lisääntynyt hematologinen ja myös yleinen toksisuus. Kuten kemoterapiassa, palliatiivisesta sädehoidosta ei ole saatavilla todisteisiin perustuvia tutkimuksia, jotka tukevat tämän hoitomuodon tehokkuutta parantumattomasta pään- ja niskasyövästä. Potilailla, joilla on parantumaton kasvainsairaus, on erilaisia fyysisiä ja psykologisia komplikaatioita, jotka ovat lisähaaste hoidolle. Tästä syystä näille potilaille tulisi antaa varhain ammattimaisesti suoritettava tukihoito.
On hyvin dokumentoitu, että noin 90 prosentilla suuontelon karsinoomaa sairastavista potilaista on myös karies, periodontaalinen sairaus tai suun limakalvoinfektio [Rosenberg, 1990], mutta he eivät usein tiedä hammashoidon tarpeesta [Toljanic et ai. , 2002]. Jopa jatkuvan hammashoidon optimaalisissa olosuhteissa potilaan ohjaustapa voi olla ongelmallista, koska 51 prosenttia heistä lopettaa jälkitoimenpiteet ajan myötä [Epstein et al., 1998]..
Koska potilailla on toiminnallisesti vammaisia kasvaimiin liittyvien hampaiden ja / tai leukojen poistamisen jälkeen ja heidän elämänlaatu on huomattavasti heikompi kuin proteesilla hoidetuilla potilailla [Allison ym., 1999], hampaiden kuntoutuksen järjestäminen on tärkeä tehtävä kasvaimen jälkihoidossa. Proteesin palauttaminen voi olla ongelmallista postoperatiivisesti muuttuneen anatomian vuoksi ja vaatii usein lääkärin erityistä sitoutumista. Vaikka hammasimplanttien asettaminen jäljellä olevaan leukaluuhun tai mikrovaskulaarisiin anastomisoituihin luusiirteisiin on johtanut proteesimahdollisuuksien huomattavaan laajenemiseen, säteilytetyn luun – etenkin tupakoitsijoiden – implantaattien menetyksen lisääntymisen on odotettavissa [Mericske-Stern et ai. , 1999]. Suun syöpään leikattujen ja / tai säteilytettyjen potilaiden sopivimmasta proteesimenetelmästä ei ole riittävästi näyttöä [McCord et al., 2004]. Pään ja niska-alueen säteilyhoidon jälkeisestä implantoinnista viitataan S3-ohjeeseen "Implantin palauttaminen suun kuntoutukseen pään ja niska-säteilyn yhteydessä" (AWMF 007-089)
Johtopäätös hammashoidosta
Hammasharjoittelu on ratkaisevan tärkeää suun karsinooman havaitsemisessa, hoidon tukemisessa ja toiminnallisessa kuntoutuksessa. Erityisesti säteilytettyjen potilaiden kohdalla vaaditaan sitoutumista välttämään kovan hampaan aineen, periodontaalisen ja leukaluun komplikaatioita. Hammaslääkärit ovat avainasemassa parantamalla suun syövän onnistumista varhaisen havaitsemisen avulla.
yhteenveto
Suussyövän hoidossa edistymiseksi kehitettiin ensimmäistä kertaa kliininen suuntaviiva yhteistyössä 21 ammatillisen yhdistyksen ja konsortion kanssa ja Saksan syöpäyhdistyksen tuella korkeimmalla todistustasolla (S3). De novo -tutkimuksen, systemaattisten katsausten, metaanalyysien ja todistepohjaisen lähdeohjeen (SIGN 90) perusteella muotoiltiin 71 lausumaa ja suositusta suun karsinooman diagnosointiin ja hoitoon. Ohjeen taustatekstin selitykset antavat myös ulkopuolisille kollegoille mahdollisuuden tiedottaa potilaille asiantuntijoiden menettelyistä ja neuvoa heitä hoidon sivuvaikutuksista tai riskeistä. Johdonmukaisen käytön odotetaan parantavan potilaiden ennustetta.
Related Posts
-
Tarkkailu osaamisella: zm-online
Tarkkaileminen osaamisella Älä vain katso, vaan autta itseäsi. Dresdenin hammaslääketieteen opiskelijat voivat nyt kokea vierailun aikana valituissa…
-

Maailman hammasfoorumi 2017 – suomi: zm-online
Katsaus digitaalisen proteesin tulevaisuuteen Digitaalitekniikka tarjoaa laajan valikoiman uusia mahdollisuuksia proteesien hoidossa. Maailman…
-
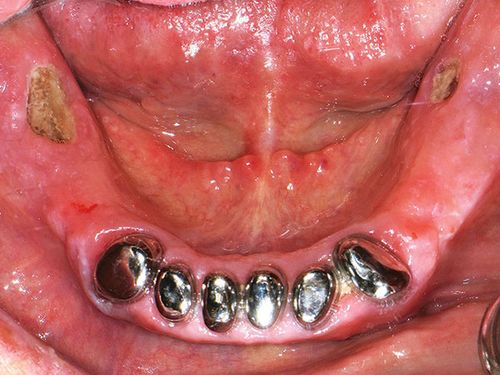
Huumeisiin liittyvä mäntynekroosi: zm-online
Lääkkeisiin liittyvä mäntynekroosi Proteesipaine aiheutti huumeisiin liittyvää mäntynekroosia alaleuassa >MKG Heidelberg bibliografia Bedogni, A., S….
-

Dentistry faq »hammaslääketieteen klinikka herne
Potilaakysymykset – Annamme sinulle vastauksia: Haluatko kysyä kysymyksen? Lähetä sitten meille sähköpostia osoitteeseen: marketing [✉] zpk-herne.de…
