tutkimus
Virologian instituutti
tutkimus
Virologisen instituutin tutkimus keskittyy tärkeään ihmisen patogeeniseen virukseen, ihmisen sytomegalovirus (HCMV). Se on yleinen herpesvirus, joka aiheuttaa infektioita noin 40 prosentilla Keski-Euroopan väestöstä. Monissa tapauksissa näillä infektioilla ei ole selviä oireita. Virus jatkuu kuitenkin piilevässä muodossa tartunnan saaneiden kehossa: se voi aktivoida uudelleen elämänsä aikana ja aiheuttaa taas sairauden oireita. Tämä liittyy hyvin usein heikentyneeseen immuunitoimintaan, niin että HCMV: tä pidetään yhtenä tärkeimmistä patogeeneistä immunosuppressoiduissa potilaissa (esim. Elinsiirtopotilaat). Lisäksi tämä virus voi aiheuttaa syntymättömän lapsen tartunnan raskauden, pysyvän ja z.T. vahingoittaminen lapselle. Tutkimuksessamme karakterisoimme molekyylin yksityiskohdat viruksen pääsystä kohdesoluun (AG Sinzger →), virusgeeniekspressio (AG Stamminger →) ja viruksen morfogeneesi (Yksi →) kehittää uusia viruslääkityshoitoja ja lääkkeitä. Lisäksi käsittelemme virusten patogeneesin avoimia kysymyksiä ja virusresistenssimekanismien analyysiä (AG Michel →) .
Tutkimusryhmä Prof. Dr. med. Thomas Stamminger
HCMV-säätelyproteiinit ja luontainen immuniteetti
Ihmisen sytomegalovirus (HCMV) on edelleen tärkeä syy kuolleisuuteen ja sairastuvuuteen immuunipuutostuksessa olevilla potilailla, jotka hakevat siirtohoitoa vastaan immunosuppressiivisella terapialla. Lisäksi HCMV on yleisin syy kohdunsisäiseen infektioon, joka voi johtaa sensineuraaliseen kuulon menetykseen ja henkiseen vajaatoimintaan. Vaikka edistyminen HCMV-infektioiden diagnosoinnissa on parantanut terapeuttisia strategioita, HCMV: n indusoiman sairauden hoito kärsii tällä hetkellä saatavana olevien viruslääkkeiden toksisuudesta. Lisäksi potilailla, joilla pidempi hoito on välttämätöntä, lääkeresistenttien viruskantojen esiintyminen on yleistä. Siksi uusien viruslääkkeiden kehittäminen on kiireellisesti tarpeen HCMV-infektioiden hoidon parantamiseksi. Siksi yksi laboratorioidemme tärkeistä näkökohdista on niiden molekyylitapahtumien karakterisointi, joita voidaan käyttää kohteina uusille viruslääkestrategioille.
Lab-jäsenet:

Thomas Stamminger, professori dr. med. (Vastuullinen tutkija); Myriam Scherer, dr. rer. nat.; Eva-Maria Schilling, dr. rer. nat.; Anna Reichel, tohtori opiskelija (Erlangen); Theresa Frank, tohtori opiskelija (Erlangen); Patrick King, tohtori opiskelija (Erlangen); Anne-Charlotte Stilp, tohtori opiskelija (Erlangen); Adriana, Svrlanska, tohtori opiskelija (Erlangen); Regina Müller, teknikko (Erlangen)

Professori Dr. Thomas Stamminger
Professori Dr. Thomas Stamminger
Puhelin: +49 731-500 65100 Faksi: +49 731-500 65102 Sähköposti: [email protected] Osoite: Albert-Einstein-Allee 11 89081 Ulm Rakennus: University, M23, huone 3105
PML-ydinkappaleet: solurakenne, joka välittää luontaista immuniteettia viruksia vastaan. Mikrobi-infektioita hallitsevat paitsi synnynnäiset ja mukautuvat immuunimekanismit, myös solun restriktiotekijät. Toisin kuin immuunijärjestelmän luontainen ja mukautuva osa, joita kutsutaan solujen patogeenien aiheuttamiksi signalointireiteiksi, toimii etulinjana puolustuksena. Laboratoriomme tutkii, osaltaanko ydinrakenne, jota kutsutaan PML-ydinkappaleiksi (PML-NB), solujen vastustuskykyä herpesvirusinfektioita vastaan vai ei. PML-NB: t ovat solun ytimen pistemäisiä rakenteita, jotka määritellään spesifisten soluproteiinien, kuten PML, hDaxx, Sp100 ja ATRX, selkeällä kertymisellä (kuva 1). Laboratoriomme viimeisen kymmenen vuoden aikana voimme osoittaa, että se toimii solutekijänä indusoimalla viruksen geeniekspression hiljeneminen. Lisäksi tutkimuksemme paljasti, että spesifiset virusproteiinit (HCMV: n pp71 ja IE1) kykenevät antagonisoimaan tätä solun äänenvaimennusmekanismia (kuvio 1). Tämä luo herkän tasapainon solun puolustuksen ja viruksen antagonismin välillä.
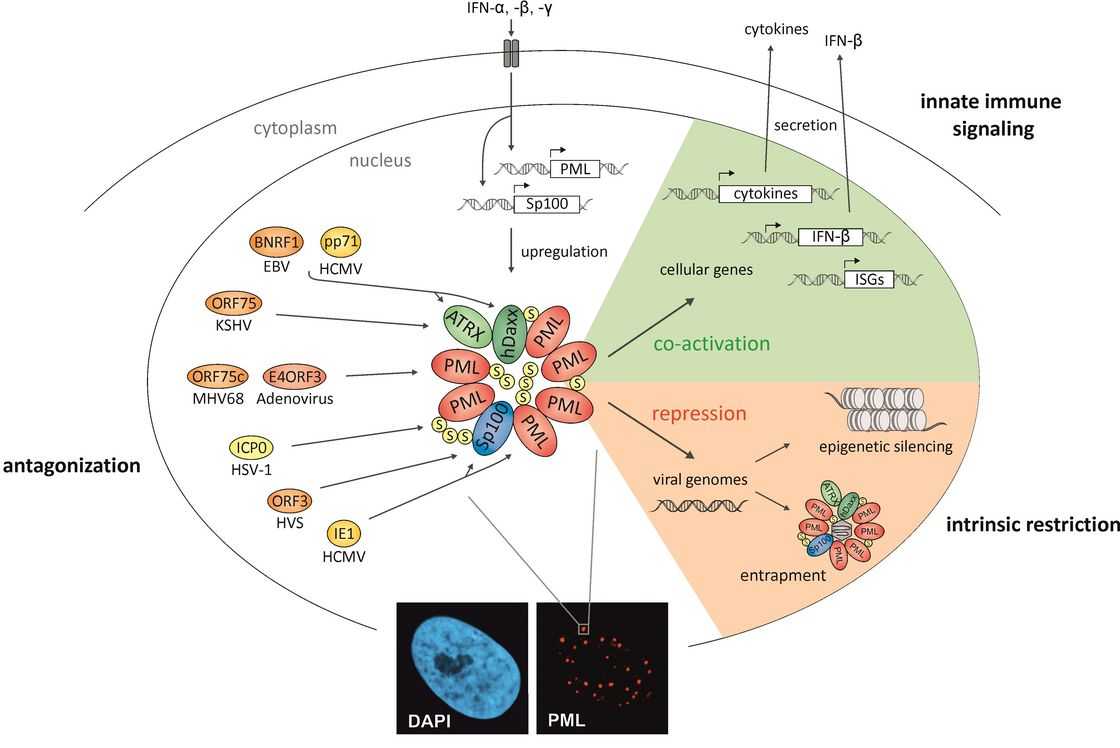
Kuvio 1: PML-NB: solurakenne, joka välittää sekä luontaista immuniteettia viruksia vastaan ja toimii interferonivasteen koaktyvaattorina. Viruksen efektoriproteiinit, joiden tiedetään antagonisoivan PML NB: t, esitetään kuvion vasemmassa osassa.
PML-NB-hajotuksen molekyylimekanismi. Kahden viime vuoden aikana voimme rajata molekyylimekanismin, kun IE1 estää PML-NB: itä. Kuten IE1: n kiderakenteesta ilmenee, tämä proteiini on vuorovaikutuksessa suoraan PML-kelatun kelan domeenin kanssa sen globaalin ytimen alueella ja häiritsee NB-polttoja indusoimalla PML SUMOylaation menetys. Pystyimme osoittamaan, että IE1 toimii kumoamalla de novo PML: n SUMOylaatio. Yhteenvetona voidaan todeta, että SUMOylaatiodynamiikka, IE1-ekspressio SUMO-mutantilla, joka on resistentti SUMO-proteaaseille. Mielenkiintoista on, että havaitsimme, että IE1-lauseke ei vaikuttanut esSUMOyloituun PML: ään, mutta se esti selvästi de novo SUMO-konjugaatio. Johdonmukaiset tulokset saatiin in vitro SUMOylaatiomääritykset osoittavat, että pelkästään IE1 riittää tähän vaikutukseen. Lisäksi IE1 toimii selektiivisesti, koska K160 tunnistettiin lysiinin pääkohteeksi. Tämä johtuu siitä, että IE1 on niin2O3-välittänyt K160: n hyper-SUMOylaatio. Koska IE1 ei häirinnyt käämityskelan välittämää PML-dimerointia, ehdotamme, että IE1 joko vaikuttaa PML-autoSUMOylaatioon poistamalla suoraan PML E3 -ligaasitoiminnot tai tekemällä pääsy SUMO-sivustoihin. Siksi tietomme ehdottavat uutta mekanismia, kuinka virusproteiini toimii vasta-aineena solujen restriktiotekijään de novo SUMOylaatio spesifisillä lysiinitähteillä vaikuttamatta globaaliin proteiinin SUMOylaatioon.
PML-ydinkappaleet luontaisten immuunivasteiden ydinsäästörakenteiksi. Todiste PML-NB: ien sisäisten ja luontaisten immuunimekanismien välisestä laaja-alaisesta keskustelusta. Esimerkiksi spesifisten PML-NB-tekijöiden, kuten PML: n ja Sp100: n, tiedetään indusoivan interferoni (IFN), ja vastaavasti PML-NB: n kokonaiskoko ja lukumäärä kasvaa solujen IFN-käsittelyllä. Tämä osoittaa, että PML-NB: ien rajoittavaa toimintaa voidaan parantaa IFN: ien avulla. Viimeaikaiset todisteet kuitenkin viittaavat siihen, että PML itsessään toimii tärkeänä yhteissäätelytekijänä interferonilla stimuloitujen geenien (ISG) induktion aikana (kuva 1). Havaitsimme esimerkiksi yhteistyössä PD: n kanssa. Tohtori P. Hemmerich (Jena), että PML-proteiini kykenee edistämään interferoni-g: n (IFN-g) indusoimaa luokan II MHC-geeniekspressiota. PML: n aktiivisuus IFN: n aktivaattorina ei kuitenkaan rajoitu tyypin II IFN: eihin, vaan ulottuu myös tyypin I IFN: n säätelemiin geeneihin. Endogeenisen PML-proteiinin ehtymistä osoittavien solujen IFN-käsittely. ISML-ekspressiota säätelevien transkriptiokompleksien PML-NB-välitteinen stabilointi. Tämän seurauksena PML-NB: t voivat paitsi antagonisoida sisäisen viruksenvastaisen puolustuksen lisäksi myös immuunivasteita HCMV: n IE1-proteiiniin..
HCMV-koodattujen G-proteiini-kytkettyjen reseptorien signalointi. G-proteiiniin kytketyt reseptorit (GPCR) ovat avainregulaattoreita lukuisissa soluprosesseissa. Siten viruskoodatut GPCR: t osoittavat tehokkaan keinon immuunijärjestelmän ohittamiseksi, solun toimintojen moduloimiseksi ja solujen signalointiverkkojen uudelleenohjaamiseksi. Ihmisen sytomegalovirus (HCMV) koodaa neljää GPCR-homologia, nimeltään pUS27, pUS28, pUL33 ja pUL78. Koska pUS28 ja pUL33 aktivoivat konstitutiivisesti useita signalointikaskadeja, pUS27: n ja pUL78: n toimintoja ei vielä tunneta täysin. Sen määrittämiseksi, onko pUS27: lla vai pUL78: lla signalointiominaisuuksia, suoritimme lusiferaasireportterimääritykset 293T-soluissa, jotka oli transdusoitu CREB-, NFAT- ja NF-KB-spesifisillä reportterirakenteilla. Kokeemme osoittavat, että pUS27 aktivoi NF-KB: stä riippuvan geeniekspression. Kiinnostavaa kyllä, osoittautui, että NF-κB -aktivaatio erottui huomattavasti riippuen siitä, käytettiinkö pUS27: n N- tai C-päätteisesti merkittyjä versioita: Vaikka N-päätteisesti merkityn pUS27: n transfektio ei aktivoinut NF-κB: tä, C-terminaalisesti merkittyjen ilmaisu versiot indusoivat voimakkaasti NF-KB-signalointia. Mahdollisen PDZ-domeenin sitoutumismotiivin häiriintyminen lisäämällä yksi seriini pUS27: n indusoimaan korkean NF-KB-C-päähän C: n päähän, mikä viittaa siihen, että pUS27: ta voidaan säätää negatiivisesti PDZ-domeeniproteiinin kautta. Bioinformaattinen analyysi paljasti neljän oletetun TRAF-sitoutumismotiivin olemassaolon pUS27: n C-päässä. Mielenkiintoista on, että ennustetun TRAF6-sitoutumismotiivin mutaatio johti NF-KB-signaloinnin täydelliseen menettämiseen. Pelkästään pUS27: n C-terminaalinen alue on välttämätön ja riittää NF-KB: n aktivointiin, tuotimme kimeerisiä proteiineja joko CD8: lla tai GFP: llä. Nämä kimeerit aktivoivat voimakkaasti NF-KB-signaloinnin riippumatta niiden sijainnista joko vastaavasti solun pinnalla tai endosomeissa. Tämä osoittaa, että pUS27-sytoplasmisen domeenin solun paikallinen sijainti ei ole kriittinen NF-KB: n aktivoitumiselle. Lisäksi pystyimme indusoimaan kanonisen NF-KB-reitin TRAF6: n läpi joko ACHP: llä, IKKp-fosforylaation estäjällä, tai hallitsevalla negatiivisella IκBa: lla. Yhteenvetona tietomme paljastavat uuden ja erittäin monimutkaisen merkinantokyvyn HCMV GPCR pUS27: llä.
Ihmisen sytomegaloviruksen UL69: viruksen mRNA: n vienti, jota säädellään erillisillä translaation jälkeisillä modifikaatioilla. Ihmisen sytomegaloviruksen avoin lukukehys UL69 koodaa monitoiminnallista säätelyproteiinia pUL69, joka toimii viruksen mRNA: n vientitekijänä sen nukleosytoplasmisen sukkula-aktiivisuuden kautta ja rekrytoimalla solun mRNA: ta vievät koneet vuorovaikutuksessa solun DExD / H-box-RNA: n kanssa. helicase UAP56. Olemme aiemmin ilmoittaneet, että pUL69: n solun paikallinen lokalisaatio ja mRNA: n vientiaktiivisuus moduloidaan viruskinaasin pUL97 fosforylaatiolla. Äskettäisessä tutkimuksessa pUL69: lle tehtiin lisää translaation jälkeisiä muunnoksia, kuten arginiinimetylointi. Ensin osoitimme täysipitkän pUL69: n ja pUL69aa1-146: n spesifisen immunosaostuksen mono- / dimetyyliaginiinispesifisellä vasta-aineella. Toiseksi havaitsimme spesifisen elektroforeettisen liikkuvuuden siirtymisen katalyyttisesti aktiivisen proteiiniarginiinimetyylitransferaasin 6 (PRMT6) yliekspression yhteydessä. Kolmanneksi pUL69: n ja PRMT6: n suora vuorovaikutus varmistettiin hiivan kaksihybridisillä ja koimmunosaostuksilla. Kartoitimme PRMT6-vuorovaikutusmallin pUL69 N -päähän ja tunnistimme kriittiset aminohapot pUL69: n arginiinirikkaassa R1-laatikossa, jotka olivat kriittisiä PRMT6: n ja / tai UAP56-rekrytoinnin kannalta. Jotta voitaisiin testata oletetun metylaatiosubstraatin vaikutus pUL69: n funktioihin, konstruoimme erilaisia pUL69-johdannaisia, joissa on arginiinin ja alaniinin substituutioita, ja testattiin niitä RNA: n vientiaktiivisuuden suhteen. Siten pystyimme erottelemaan arginiinit pUL69: n R1-laatikon sisällä, jotka olivat tärkeitä UAP56 / PRMT6-vuorovaikutukselle ja / tai mRNA: n vientiaktiivisuudelle. Huomattava, ydinmagneettinen resonanssi (NMR) analysoi samat a-kierteiset rakenteet pUL69-sekvensseille, jotka koodaavat villityyppisiä R1 / R2-laatikoita tai UAP56 / PRMT6-sitoutumisvajavaa johdannaista, sulkemalla siten pois R / A-aminohapposubstituutiot R1 vaikutti pUL69: n sekundaariseen rakenteeseen. Päätelmämme on, että PRMT6 metyloi pUL69 N-terminuksen ja että tämä vaikuttaa kriittisesti pUL69: n toimintoihin tehokkaassa mRNA: n viennissä ja ihmisen sytomegaloviruksen replikaatiossa. Lisäksi pyrimme tunnistamaan fosforylaatiopaikat pUL69: n toiminnallisesti tärkeässä N-päässä ja karakterisoimme in vivo merkitys HCMV-replikaatiolle. In silico Analyysit ennustivat 13 seriinin ja 3 treoniinin olemassaolon oletettuina fosforylointikohdina pUL69: n toiminnallisesti tärkeissä N-terminaalisissa 140 aminohapoissa. Immunopuhdistetun FLAG-pUL69: n MS-pohjainen fosfosiittikartoitus tunnisti S18: n, S51: n ja T52: n erittäin todennäköisiksi fosforylointikohdiksi transfektoiduissa HEK293T-soluissa. CoIP-analyysit paljastivat, että S13 + 15 + 16 + 18: n kombinatorinen vaihto alaniiniksi poisti pUL69: n kyvyn olla vuorovaikutuksessa UAP56: n kanssa. Siksi oletamme, että solukinaasit fosforyloivat tämän seriinin venytettäessä ylävirtaan alfa-heliksiä1 ja määrittävät siten UAP56-rekrytoinnin rekrytoinnin pUL69: lla. Vertaamalla pUL69-mutanttien ekspressioprofiileja, jotka kuljettavat oletettujen fosfosiittien yksilöllisiä tai kombinatorisia substituutioita fos-tag-SDS-PAGE: n kautta, tarjoamme vahvan näytön siitä, että useat seriinit fosforyloituivat, kun pUL97-villityyppi, mutta ei silloin, kun sen katalyyttisesti inaktiivinen johdannainen pUL97-K355M koekspressoidusta. Koska pS46 ja pS49 alfa-helix2: ssä ovat molemmat edeltäneet proliinia, arvelimme, että ne saattavat olla substraatteja Pin1-välitteiselle peptidyyliprolyyliille cis-trans-isomerointi ja varmisti pUL69: n ja Pin1: n kompleksin muodostumisen CoIP-kokeilla. NMR-kokeet fosforyloinnin vaikutuksen määrittämiseksi pUL69: n rakenteeseen ovat käynnissä. Biokemiallisen tuotteemme mukaisesti in vitro HB15-johdettu virus, joka kuljettaa S / T: n A-substituutioita pUL69-N-päässä. Olemme tunnistaneet pUL69: n fosfosiitit, joita tarvitaan vastaavasti UAP56: n tai Pin1: n rekrytointiin, ja vahvistaneet niiden in vivo tärkeys HCMV-replikaatiossa.
yhteistyötä
- Professori Dr. Manfred Marschall, kliinisen ja molekyylin virologian instituutti, Erlangen-Nürnbergin yliopisto, Saksa
- Professori Dr. Armin Ensser, kliinisen ja molekyylin virologian instituutti, Erlangen-Nürnbergin yliopisto, Saksa
- Professori Dr. Thomas Gramberg, kliinisen ja molekyylin virologian instituutti, Erlangen-Nürnbergin yliopisto, Saksa
- Professori Dr. Yves Muller, biotekniikan osasto, biologian laitos, Erlangen-Nürnbergin yliopisto, Saksa
- Professori Dr. Heinrich Sticht, Bioinformatiikan professori, Biokemian instituutti – Emil-Fischer-Center, Erlangen-Nürnbergin yliopisto, Saksa
- Professori Dr. Alexander Steinkasserer, immunologisen modulaation laitos, dermatologian osasto, Erlangenin yliopistollinen sairaala, Saksa
- PD Dr. Christian Heim, sydänkirurgian osasto, Erlangenin yliopistollinen sairaala, Saksa
- Professori Dr. Uwe Sonnewald, biokemian osasto, biologian laitos, Erlangen-Nürnbergin yliopisto, Saksa
- PD Dr. Peter Hemmerich, Leibnizin ikäntutkimusinstituutti – Fritz Lipmann-Institut e.V., Jena, Saksa
- Professori Dr. Pierre Szepetowski, Neutrobiologian laitos, Mediterranee, Marseille, Ranska
- Professori Dr. Patrick Hearing, osasto Molekyyligenetiikka ja mikrobiologia, Lääketieteellinen korkeakoulu, Stony Brook University, New York, USA
- Tohtori Peter Lischka, AiCuris GmbH & Co KG, Wuppertal, Saksa
- Professori Dr. Jin-Hyun Ahn, molekyylikolubiologian laitos, Sungkyunkwan University University School of Medicine, Suwon, Korean tasavalta
- Professori Dr. J. Sinclair, Addenbrooke’s Hospital, Cambr >
rahoitusta
- Deutsche Forschungsgemeinschaft, SFB 796, "Isäntäsolujen uudelleenohjelmointi mikrobiefektoreilla", B3 (joulukuuhun 2017 asti), vuodesta 2018 lähtien STA 357 / 7-1
- Monitieteinen kliinisen tutkimuksen keskus Erlangen (IZKF), projekti A71
- Wilhelm Sander -säätiö nro 2016.087.1
Related Posts
-
Saarlandin yliopiston lääketieteellinen keskus – tutkimus
tutkimus tiede Perustavan ja kliinisesti suuntautuneen tieteen suositukset ovat Saarlandin yliopiston lääketieteellisen tiedekunnan ydinvastuu. Viime…
-
yksityisyyden suoja yksityisyyden suoja Kiitos mielenkiinnostasi online-läsnäolomme kohtaan. Henkilötietojesi suojaaminen on meille erityisen tärkeää….
-
Theranostics – yliopistollisen sairaalan ulm
Theranostic PD Dr. med. V. Prasad Ryhmänjohtaja PD Dr. med. V. Prasad Ryhmänjohtaja Ydinlääketiede Theranostic Theranostic -ryhmä Syöpä on yksi…
-

Rakutenin tutkimus: Kansainvälinen joulukauppa
Kansainvälinen jouluyritys Rakuten on tarkastellut ostajan mieltymyksiä ennen tämän vuoden tulevaa joulualan yritystä. Vaakalaudalla oleva kysymys:…
