
Site: www.uniklinik-ulm.de
Virukset moduloivat lukuisia solureittejä ja kaappaavat lukuisat isäntätekijät tehokkaan replikaation ja leviämisen varmistamiseksi. Esimerkiksi monet viruspatogeenit hyödyntävät soluseeriiniproteaasifuriinia verhokäyränsä glykoproteiinien proteolyyttiseen kypsymiseen. Laboratoriomme on äskettäin tunnistanut guanylaattia sitovat proteiinit 2 ja 5 (GBP2 ja GBP5) kahdeksi IFN: llä indusoitaviksi isäntätekijöiksi, jotka vähentävät furiinin proteolyyttistä aktiivisuutta (Braun ja Hotter ym., 2019). Seurauksena on HIV-1-verhokäyrän (Env) edeltäjän gp160 muuntaminen funktionaaliseksi kypsäksi gp120 / gp41-trimeeriksi. Koska tämä prosessi on HIV-1-positiivinen membraanifuusioon, GBP2: n ja GBP5: n läsnä ollessa tuotetut viruspartikkelit ovat vain heikosti tarttuvia. Samoin GBP2 ja GBP5 rajoittavat siten muiden furiinista riippuvien virusten, mukaan lukien Zika, tuhkarokko ja erittäin patogeeninen lintuinfluenssa A -virukset, replikaatiota (kuva 1). Sitä vastoin vesikulaarisen stomatiitin viruksen proteaasista riippumattomia glykoproteiineja kantavien virionien infektiivisyys ei vähene. Mutaatioanalyysit paljastivat, että GBP2: n ja GBP5: n viruksenvastainen aktiivisuus vaatii C-terminaalisen lipidikalvoankkurin, mutta ei niiden GTPaasiaktiivisuutta. Lisäksi tuloksemme osoittavat, että GBP2: n ja GBP5: n ilmentymistä ohjaavat endogeeniset retroviruspromoottorit, jotka aktivoituvat virusinfektiossa.
Jun.Prof. Daniel Sauter
Jun.Prof. Daniel Sauter
Puhelin: +49731 500 65169 Faksi: +49731 500 65153 Sähköposti: [email protected] Osoite: Meyerhofstr. 1 89081 Ulm Rakennus: N27-huone 2.072
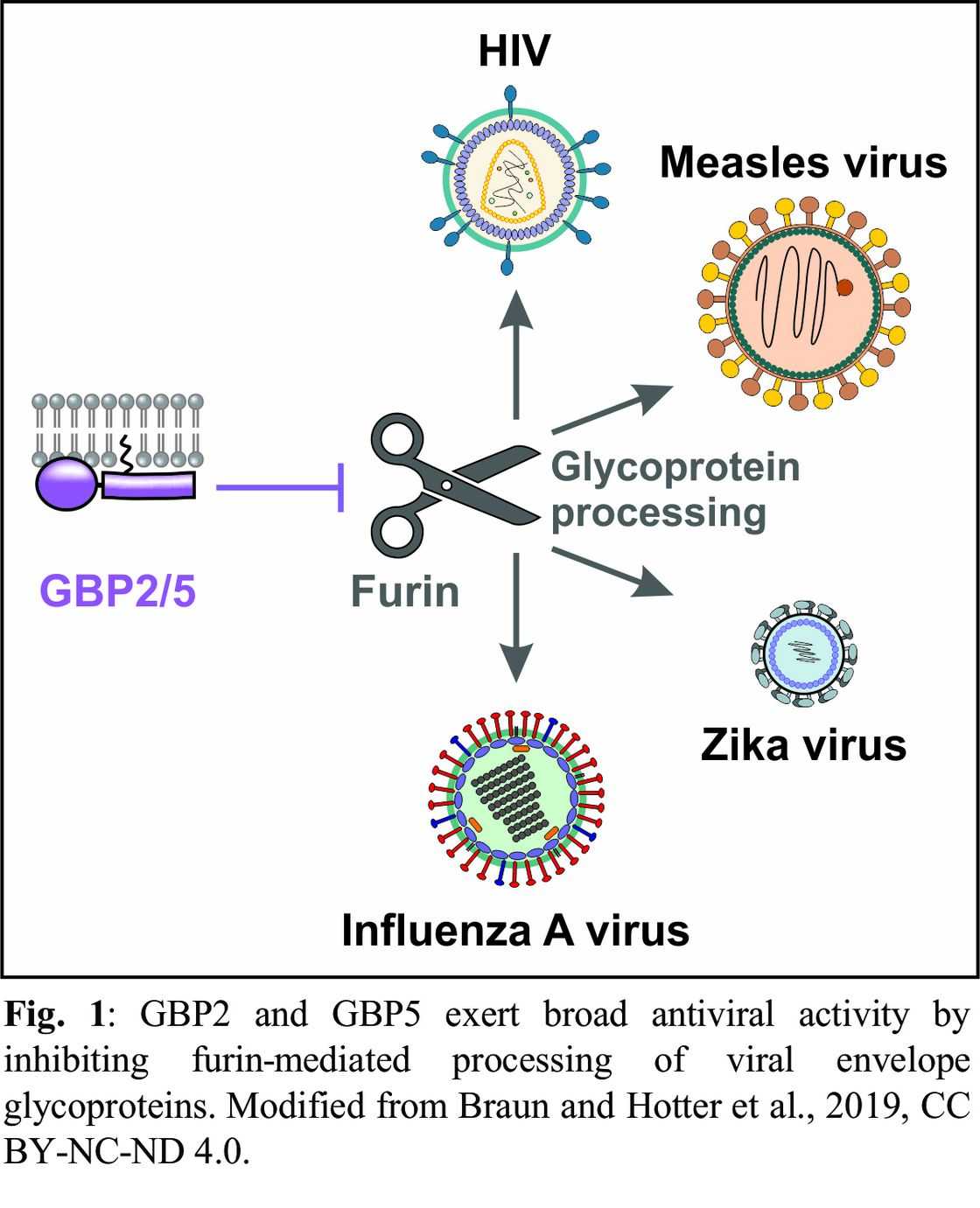
Koska furiini ja pilkkoutuminen ja aktivoi erilaisia isäntäsolutekijöitä samoin kuin bakteeritoksiineja, sen säätely GBP2: lla ja GBP5: llä voi olla tärkeä rooli virusinfektioiden lisäksi (Braun ja Sauter et ai., 2019). Todellakin, GBP2 ja GBP5 estävät siten soluproteiinien proteolyyttistä kypsymistä, mukaan lukien tuumorin kehitykseen liittyvät tekijät (Braun ja Hotter et ai., 2019). Ymmärtääksemme paremmin GBP2: n ja GBP5: n merkitystä proteolyyttisen proteiinin kypsymisessä, tutkimme parhaillaan, häiritsevätkö nämä kaksi proteiinia furiinin kypsymistä ja aktiivisuutta vai eivät..
NF-KB: n aktivoinnin modulointi kädellisten lentivirusten avulla
Solutranskriptiotekijä NF-kB säätelee tulehdukseen ja immuniteettiin osallistuvien geenien ilmentymistä, mukaan lukien interferonilla stimuloidut geenit, jotka suojaavat viruspatogeenejä vastaan. Silti NF-kB ei ole vain virusvälitteisten immuunivasteiden välittäjä, vaan myös monet virukset käyttävät niitä virusgeenien transkriptioon. Esimerkiksi HIV: n replikaatio riippuu NF-kB p65 / p50-heterodimeerien sitoutumisesta virus LTR-promoottoriin.
Olemme aiemmin osoittaneet, että kädellisten lentiviruset säätelevät tiukasti tämän transkriptiotekijän aktivointia koko replikaatiosyklin ajan. Useimpien kädellisten lentivirusten varhainen proteiini Nef tehostaa NF-kB: n aktivaatiota aloittamaan LTR-riippuvainen virusgeeni-ilmentyminen, Vpu estää NF-kB: n aktivaatiota viruksenvastaisen immuunivasteen induktion myöhemmissä vaiheissa (Sauter et ai., 2015; Heusinger ja Kirchhoff, 2017). HIV-1-tartunnan saaneiden primäärisolujen transkriptoanalyysit paljastivat, että Vpu: lla on laajoja immuunivastetta haittavaikutuksia, koska sen kyky estää NF-KB: n aktivaatiota vähentää tulehdusta edistävien sytokiinien, restriktiofaktorien ja muiden virusten vastaisten geenien ilmentymistä (Langer, Hammer ja Hopfensperger et ai., 2019).
Virukset, jotka eivät koodaa a vpu geenin aloitusvaihtoehtoiset strategiat immuuniaktivaation estämiseksi virusgeenin ilmentymisen NF-kB: stä riippuvan aloittamisen jälkeen. Esimerkiksi useimpien virusten Nef-proteiinit, jotka suihkuttavat a vpu moduloi T-solureseptori CD3 solun pinnalta. Tämä Nef-toiminto menetettiin suurimmassa osassa vpu-ekspressoivat viruksia, mikä viittaa siihen, että Vpu-välitteisen NF-KB-estämisen saaminen on voinut vähentää valintapainetta Nef: n T-soluaktivaation estämiseksi. Olemme äskettäin tunnistaneet kaksi virusta, SIVcol ja SIVolc, joilla on vielä uusi strategia, ja käytämme niiden Vpr-proteiiniaan NF-kB-välitteisen immuuniaktivaation tukahduttamiseen (Hotter ja Krabbe et ai., 2017). Mielenkiintoista, että nämä virukset maalaa a vpu geenin ja Nef: n CD3: n alas-modulaatiofunktio. Yhteistyössä toteutetussa tutkimushankkeessa tunnistimme HIV-2 Vpx: n NF-κB-ohjaaman geeniekspression estäjänä (Landsberg et ai., 2018). Siksi kädellisten lentiviruset ovat kehittäneet ainakin neljä itsenäistä mekanismia estämään solun NF-kB-kohdegeenien ilmentymistä (kuvio 2)..
Koska krooninen (NF-KB-ohjattu) immuuniaktivaatio on tunnusmerkki AIDS: lle, havainnomme auttavat ymmärtämään paremmin HIV: n patofysiologiaa. Erityisesti NF-kB: llä on avainasemassa latenssista johtuvan HIV: n reaktiossa. Niinpä HIV: n ja siihen liittyvien lentivirusten aiheuttaman NF-kB-modulaation molekyylipohjan ymmärtäminen voi myös johtaa uusiin lähestymistapoihin viruksen uudelleenaktivoimiseksi "potkia ja tappaa" -strategioille.
Related Posts
-

Saarlandin yliopistollinen sairaala – lom
tutkimus Mikä on FACTScience ja mitkä ovat LOM: n kriteerit?? FACTScienc e on QLEO Science GmbH: n PostgreSQL-pohjainen tietokantaohjelmisto, jota…
-

Kuntoutus- ja ehkäisypalvelut, sairaala, asiakirjat, tausta, aok-federaatio
sairaala Kuntoutus- ja eläkelaitokset Periaatetta sovelletaan myös lääketieteellisiin ehkäisy- ja kuntoutustoimenpiteisiin avohoidossa avohoidon edessä :…
-

Vinkkejä ei niin kovin tylsään sunnuntaihin berliiniin – matkablogin mini-globetrotteri
Vinkkejä Berliinin ei niin kovin tylsään sunnuntaihin Sunnuntai on viikonpäivä, joka ei sovi minulle. Miksi? Koska siellä ei ole paljon tekemistä….
-

Kysymyksiä ja vastauksia – Saksa keskiajalla
Kysymyksiä ja vastauksia Tällä alueella sinulla on pian mahdollisuus esittää kysymyksiä keskiajalta. Ennen kuin kaikki on valmis, löydät vastauksia…
