EU: n lääkinnällisistä laitteista annettu asetus (MDR), julkaistu EU: n virallisessa lehdessä – voimaantulo 25. toukokuuta 2017

Eurooppalaisen lääkinnällisistä laitteista annetun asetuksen (MDR) uusi virallinen versio on julkaistu tänään (5. toukokuuta 2017) EU: n virallisessa lehdessä yhdessä IVD-asetuksen kanssa. Lääketieteellisen tekniikan liittovaltion liitto BVMed on huomauttanut tästä. Eurooppalaisten asetusten virallinen voimaantulo on 20 päivää julkaisemisesta, toisin sanoen 25. toukokuuta 2017. MDR on sitten pakollinen kolmen vuoden siirtymäkauden jälkeen 26. toukokuuta 2020 alkaen. BVMed uskoo, että siirtymäkausi on rajoitettu johtuen suuresta määrästä uusia ilmoitetun laitoksen vaatimuksia, lääkinnällisten laitteiden kliinisestä arvioinnista, uusista suunnittelu- ja raportointivaatimuksista sekä uudesta EUDAMED / UDI-tietokantajärjestelmästä.
BVMed tiedottaa jäsenyrityksilleen aiempien konferenssien, seminaarien ja julkaisujen lisäksi "MDR kesäleirillä" 26. ja 27. kesäkuuta 2017 Dusseldorfissa yksityiskohtaisesti asetuksen uusista vaatimuksista. "Uudet määräykset asettavat raskaan taakan etenkin pienille ja keskisuurille yrityksille. Siksi BVMed kampanjoi lääketieteellisten pk-yritysten kansallisen rahoitusohjelman luomiseksi ", sanoo BVMed: n toimitusjohtaja ja hallintoneuvoston jäsen Joachim M. Schmitt.
MDR: n tärkeimmät innovaatiot ovat:
- "Tarkastusmenettely" luokan III implantteille ja luokan IIb aktiivisille tuotteille, jotka toimittavat tai toimittavat lääkkeitä.
- Uusi markkinavalvonta-asetus lyhyemmillä ilmoitusajoilla.
- Lisäraportit ja -suunnitelmat, kuten: markkinoille saattamisen jälkeinen valvontasuunnitelma / -raportti (PMS), markkinoilletulon jälkeinen kliininen seurantaraportti (PMCF), määräaikainen turvallisuuspäivitysraportti (PSUR), yhteenveto turvallisuudesta ja kliinisestä suorituksesta (SSCP).
- Huomattavasti korkeammat vaatimukset kliinisen tiedon valmistelussa, esimerkiksi kliinisessä arvioinnissa.
- UDI-merkin porrastettu käyttöönotto.
- Tiettyjen materiaalisten ja kirurgisten invasiivisten lääkinnällisten laitteiden korkeampi luokitus.
Voimaantulon jälkeen MDR tuottaa seuraavan aikataulun:
- MDR: n voimaantulon jälkeen alkaa asetuksessa säädetty kolmen vuoden siirtymäkausi, jonka aikana valmistajat voivat valinnaisesti edelleen olla sertifioituja vanhan lain tai jo uuden lain nojalla..
- Koska ilmoitetut laitokset voidaan nimetä uudelleen aikaisintaan kuuden kuukauden kuluttua voimaantulosta uuden lainsäädännön mukaisen sertifioinnin suorittamiseksi, valmistajien siirtymäaikaa lyhennetään tällä ajanjaksolla.
- Myöhemmin 50–60 ilmoitettua laitosta nimettiin Euroopassa uuden lain mukaisesti. Tämä tehdään useiden kansallisten viranomaisten "yhteisen arvioinnin" avulla, mukaan lukien Euroopan komission edustaja. Tämä menettely vie vähintään 12 kuukautta, mutta sen odotetaan olevan 18 kuukautta.
- Vasta sitten, vuodesta 2019 alkaen, valmistajat voivat jättää uudelleensertifiointihakemuksensa hiljattain nimetylle elimelle, jollei komissio tällä välin asettaisi vaihtoehtoisia vaatimuksia..
- Uudelleensertifiointiprosessi vie vähintään 12 kuukautta.
- Kolmen vuoden siirtymäkausi on kauan ohitettu, kunnes kaikille EU: n ja EU: n ulkopuolisten maiden valmistajille on myönnetty jälkisertifikaatti.
- Tämä valitettava tilanne tarkoittaa, että asiantuntijalausunnon mukaan valmistajia neuvotaan jatkamaan vanhojen todistusten voimassaoloaikaa vähän ennen kolmen vuoden siirtymäkauden päättymistä. Niitä jatketaan sitten enintään neljä vuotta MDR: n käyttöönottopäivästä (vuoden 2024 puoliväliin saakka)..

Ilmoitettujen laitosten olemassa olevat pullonkaulat ovat edelleen yksi suurimmista haasteista EU: n uuden lääkinnällisistä laitteista annetun asetuksen (MDR) täytäntöönpanossa. Tämän totesivat BVMed-erityistapahtuman "Lääkinnällisiä laitteita koskeva laki käytännössä" asiantuntijat, joihin osallistui yli 150 osallistujaa Kölnissä. "MDR on laaja ja vaikea tulkita. Tämä hidastaa merkittävästi uusien tuotteiden markkinoille pääsyä, jos vain ilmoitettujen laitosten resurssikysymyksistä johtuen ", Drs sanoi. Joachim Wilke, Medtronic. EU: n komission Salvatore Scalzo odottaa, että yhteensä 20 ilmoitettua laitosta ilmoitetaan MDR: n jälkeen vuoden loppuun mennessä. TÜV Südin Martin Witte: n mukaan pelkkä ilmoitettujen laitosten lukumäärä ei kuitenkaan sano paljoa. Ongelmallisempaa on, että vain muutama ilmoitettu laitos kattaa kaikki luokat ja arviointimenettelyjen asiantuntijoita puuttuu kokonaan. lisää

"Talous- ja terveyspolitiikka kuuluvat toisiinsa potilaiden ja yritysten etujen mukaisesti. Tämä on tärkeää Saksalle, jopa kansainvälisessä vertailussa", sanoi Gabriele Katzmarek, talous- ja energiavaliokunnan jäsen sekä SPD: n parlamentaarisen ryhmän työterveystaloutta käsittelevä toimittaja BVMed-keskustelupiirin terveydestä 23. lokakuuta 2019 Berliinissä. Teollinen terveysala on yksi "tärkeä tulevaisuuden kenttä", koska "Siellä musiikki soi", varsinkin kun verrataan työpaikkojen määrää Saksan autoteollisuuteen tai konepajateollisuuteen. BVMed toimitusjohtaja Tätä taustaa vasten ja myös uutta EU: n lääkinnällisistä laitteista annettua asetusta (MDR) Marc-Pierre Möll kehotti pysähtyneen lääketieteellisen tekniikan strategiaprosessin välittömään yhteiseen käynnistämiseen. Perustekijä on myös lääketieteellisten laitteiden hyväksyntämenettelyjen ja hyötyjen arviointimenettelyjen nopeuttaminen G-BA: lla. lisää
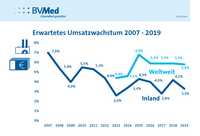
Lääketieteellisen tekniikan mieliala on selvästi heikentynyt Saksassa. Odotettu myynnin kasvu Saksassa laskee voimakkaasti vain 3,3 prosenttia edellisvuoteen verrattuna (4,2 prosenttia). Erityisen huolestuttavaa on hintojen laskun ja korkeampien kustannusten vuoksi heikentyvä voitotilanne. Nämä ovat tuloksia BVMed Autumn Survey 2019. Lue lisää
Related Posts
-

Kuolema-etuuksien vakuutus: vertailu kuolemaan
Kuolema-etuusvakuutuksen vertailu: kustannuksia ei ole jäljellä yhteenveto Kuukausittaiset maksut maksetaan vakuutusyhtiölle, joka maksaa sovitun summan…
-

Talletus: vertaile parhaita talletustilejä, 11
kiinteät talletus Pidämme sinut ajan tasalla määräaikaisilla uutisillamme riippumatta siitä, muuttuvatko laki vai korot, täältä opit kaiken , mikä on…
-

Hoito ja muuttoliike Euroopassa
Hoito ja muuttoliike Euroopassa Monissa Saksan kotitalouksissa, joissa hoidetaan ihmisiä, Keski- ja Itä-Euroopan auttajat työskentelevät. Mitkä ovat…
-
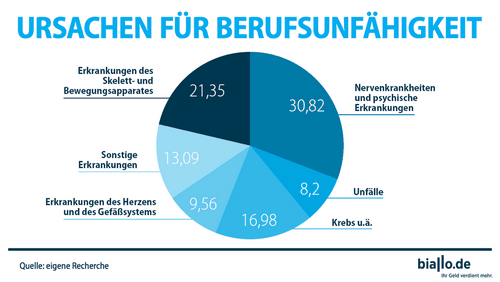
työkyvyttömyysvakuutus Miksi työkyvyttömyysvakuutuksesta on hyötyä?? Työkyvyttömyysvakuutus antaa tärkeän panoksen henkilöiden suojeluun Elämä- ja…
